
Από την αντίδραση φαίνεται ότι καταναλώνονται 0,01 mol HCl.
1. ΛύσηΛΥΣΕΙΣ - ΑΠΑΝΤΗΣΕΙΣ
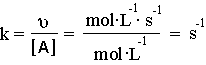
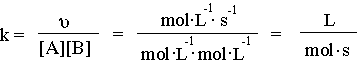
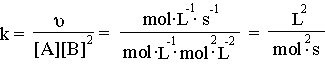
2.Λύση
Επειδή η αντίδραση είναι απλή, η ταχύτητα
δίνεται από τον τύπο
υ
= k[A][B] 2
(1)
α) Αν διπλασιάσουμε τη συγκέντρωση
του Α η ταχύτητα γίνεται
υ1 = k[2A][B]
2 =
2k[A][B] 2
(2)
Από τις (1) και (2) παίρνουμε
υ1 =
2υ. Άρα η ταχύτητα της αντίδρασης διπλασιάζεται.
β) Αν διπλασιάσουμε τη συγκέντρωση
του Β η ταχύτητα γίνεται
υ2 = k[A][2B]
2 =
4k[A][B] 2
(3)
Από τις (1) και (3) παίρνουμε
υ1 = 4υ. Άρα η ταχύτητα
της αντίδρασης τετραπλασιάζεται.
γ) Αν αραιώσουμε το διάλυμα
στο διπλάσιο του όγκου, οι συγκεντρώσεις υποδιπλασιάζονται και από
τον
νόμο της ταχύτητας παίρνουμε:
υ3 = k[0,5A][0,5B]
2 =
0,125k[A][B] 2
(4)
Από τις (1) και (4) παίρνουμε
υ3 = 0,125υ = υ/8.
Άρα η ταχύτητα της αντίδρασης υποοκταπλασιάζεται.
Επιστροφή στην εκφώνηση
3. Λύση

Από την αντίδραση φαίνεται ότι
καταναλώνονται
0,01 mol HCl.
4. Απάντηση
α) 0,025 mol/L·s,
0,025 mol/L·s β) Μηδενική.
Επιστροφή στην εκφώνηση
5. Απάντηση
α)
0,025 mol/L·s και
0,011 mol/L·s
β)
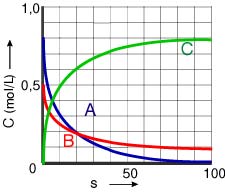 Επιστροφή
στην εκφώνηση
Επιστροφή
στην εκφώνηση
6. Λύση
Το 2 ή το 8
Επιστροφή
στην εκφώνηση
7 Λύση
Η αναλογία 1: 2 σημαίνει ότι,
αν η ποσότητα του Α είναι α mol, του Β θα είναι
2α mol.
Η εξέλιξη της αντίδρασης περιγράφεται
ως εξής:
Από τη στοιχειομετρία της
αντίδρασης και τις αρχικές ποσότητες,
προκύπτει ότι καταναλώνονται
πλήρως τα
αντιδρώντα. Άρα α - χ = 0 =>α = χ. Από το
αποτέλεσμα αυτό συμπεραίνουμε ότι, με το
πέρας της αντίδρασης καταναλώνονται πλήρως
οι ποσότητες των Α και Β. Άρα οι καμπύλες των
Α και Β είναι φθίνουσες και τείνουν ασυμπτοτικά στον άξονα των τιμών 0 (t).
Άρα το ζητούμενο διάγραμμα είναι:
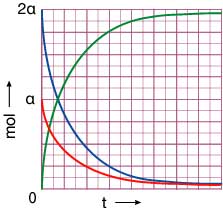 Επιστροφή στην εκφώνηση
Επιστροφή στην εκφώνηση
8. Απάντηση
α)
β)
0,0125 mol/L.s
Επιστροφή
στην εκφώνηση
9. Απάντηση
a
2, b 6, c 3, d 5.
Επιστροφή
στην εκφώνηση
10. Απάντηση
α) 0,02 mol/L·s, 0,01 mol/L·s, 0,005
mol/L·s, 0,0025 mol/L·s, 0,009375 mol/L·s,
β)
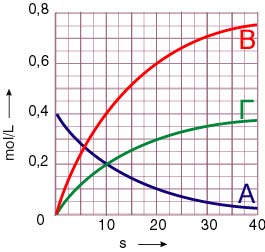
Επιστροφή
στην εκφώνηση
11. Λύση
Η εξέλιξη της αντίδρασης περιγράφεται
ως εξής:

α)0,2 mol, 0,1 mol και 0,1 mol
β)
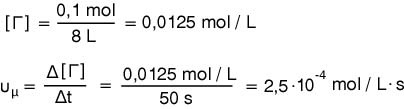
Επιστροφή
στην εκφώνηση
12. Λύση
Η ταχύτητα δίνεται από τον τύπο
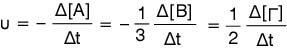
Άρα οι ζητούμενες ταχύτητες κατανάλωσης
και παραγωγής είναι:
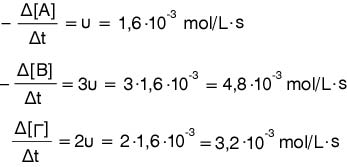
υ = -Δ[Α] / Δt => -Δ[Α] = υ·Δt = 1,6·10-3·50
= 0,08 mol/L Άρα η συνολική
ποσότητα του Α που καταναλώνεται είναι
2,5.0,08 = 0,2 mol.

Άρα η σύσταση
του μίγματος μετά την παρέλευση των 50 s είναι:
0,4 mol του Α, 0,3 mol
του Β και 0,4 του Γ.
Επιστροφή
στην εκφώνηση
Επειδή
δεν γνωρίζουμε αν η αντίδραση είναι απλή (ενός μόνον σταδίου) και
δεν έχουμε άλλη σχετική
πληροφορία, αγνοούμε τον τρόπο αναγραφής που δόθηκε
και γράφουμε τον νόμο της ταχύτητας ως εξής:
υ = k[A]x[B]y
Από τον τύπο αυτό για καθεμία από τις μετρήσεις παίρνουμε τις παρακάτω εξισώσεις.
4·10-3 = k 0,1x0,1y (1)
8·10-3 = k 0,2x0,1y (2)
1,6·10-2 = k 0,1x0,1y (3)
Από τις (1) και (2) παίρνουμε:
![]()
Από τις (1) και (3) παίρνουμε:
![]()
α) Ο νόμος της ταχύτητας δίνεται από τον τύπο υ = k[A][B] 2
β) Η τάξη της αντίδρασης είναι ν = 1+2 = 3 (Τρίτης τάξης)
γ) Από την (1) παίρνουμε
14. Απάντηση
β)
ν = 3, γ) 0,5L3
mol-3·s-1,
δ) 7,5·10-3
mol·L-1·sec
Επιστροφή στην εκφώνηση
β) ν=4,
γ) k=9L3·mol-3·s-1
Επιστροφή στην εκφώνηση
Γνωρίζουμε ότι η μερική πίεση ενός αερίου, συστατικού
κάποιου μίγματος, δίνεται από τον τύπο
ΡΑ
= [Α]RT , από τον οποίο παίρνουμε [Α] = PA
/ RT. Από τη
σχέση αυτή φαίνεται ότι η μερική πίεση
ενός αερίου αποτελεί μέτρο της συγκέντρωσης του στο αέριο μίγμα.
Σύμφωνα
με τα παραπάνω, οι αριθμητικές τιμές των μερικών πιέσεων των αντιδρώντων,
είναι οι
σχετικές τιμές των συγκεντρώσεών τους. Επομένως ο νόμος της ταχύτητας,
για την παραπάνω
αντίδραση, μπορεί να γραφεί και με τη μορφή
υ = k·PAx PyB όπου k σταθερά με τις κατάλληλες μονάδες (διαστάσεις).
Όπως και στη λύση της άσκησης 3, για να γράψουμε τον νόμο της ταχύτητας αδιαφορούμε για
τους συντελεστές της αντίδρασης, διότι δεν γνωρίζουμε από την εκφώνηση
αν αυτή είναι απλή
(ενός μόνον σταδίου). Από την παραπάνω έκφραση του νόμου
της ταχύτητας, για καθεμία από
τις μετρήσεις παίρνουμε:
1,25·10-3 = k 0,2x0,25y (1)
2,5·10-3 = k 0,4x0,125y (2)
5·10-3 = k 0,4x 0,25y (3)
από τις (1) και (3) παίρνουμε
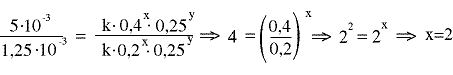
από τις (2) και (3) παίρνουμε
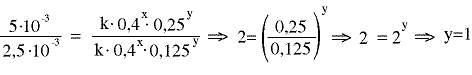
Ο νόμος της ταχύτητας γράφεται υ = k·PA2PB
Η αντίδραση είναι τρίτης τάξης διότι ν = 2+1= 3
ν = 2, k = 5·10-3
mol·L-1
s-1 atm-2
Επιστροφή
στην εκφώνηση
18 Απάντηση
α) ν = 0, β) mol/L·sec
Επιστροφή στην εκφώνηση
19. Λύση
Οι αρχικές συγκεντρώσεις είναι
![]()
Η εξέλιξη της αντίδρασης φαίνεται
στον ακόλουθο “πίνακα”
2ΝΟ +
Ο
2ΝΟ2
0,3
0,2 0
(αρχικά mol/L)
0,2
0,1 0,2
(mol/L που αντιδρούν και παράγονται)
0,1
0,1 0,2
(τελικά mol/L)
Επειδή από την εκφώνηση είναι γνωστό ότι η ταχύτητα είναι απλή (ενός μόνον σταδίου) έχουμε:
υ = k[NO]2[O2].
Ο τύπος αυτός για την αρχική κατάσταση γίνεται:
![]()
Για την τελική κατάσταση έχουμε
υ2 = 0,2·0,12 0,1 = 2·10-4 mole·L-1s-1
0,45 , 0,45 και 0,9 mol
21.
Λύση
α) 6,4
/ 80 = 0,08 mol του Α.
Η εξέλιξη της αντίδρασης περιγράφεται
ως εξής:

Από την εξίσωση (1)
για P = 1,64 atm πέρνουμε χ = 0,02 mol. Άρα κατα την
χρονική αυτή στιγμή έχουμε
0,04 mol του Α, 0,04 mol του
Β και 0,02 mol του Γ. Η ταχύτητα δίνεται από τον
τύπο
υ1
= k(0,04/3)2
(2)
Επίσης από την εξίσωση (1) για P = 1,804 atm
πέρνουμε χ = 0,03 mol. Άρα κατα την χρονική αυτή
στιγμή
έχουμε 0,02 mol του Α, 0,06 mol του Β και
0,03 mol του Γ. Η ταχύτητα δίνεται από τον
τύπο
υ2
= k(0,02/3)2
(3)
Από τις (2) και (3) παίρνουμε:
υ1:υ2
= 4:1
β)
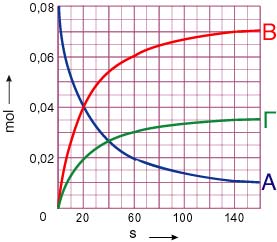
Επιστροφή
στην εκφώνηση